基于高精度循环肿瘤DNA (ctDNA) 的肿瘤分子残留病灶 (MRD) 临床研究在2025年度美国临床肿瘤学会年会 (2025 ASCO Annual Meeting) 上大放异彩,共有约60项研究在本届大会上以口头报告和海报报告形式进行展示。
MRD临床研究的爆发式增长,也证明了高精度检测手段在临床医生中的认可度越来越高,其在精准医疗中也会扮演越来越重要的角色。本届大会中,山东大学齐鲁医院 (济南) 与华大基因进行的针对胃癌术后辅助治疗决策研究入选胃食管癌壁报专场,今天小编为您带来该项研究的具体内容。
基于ctDNA的MRD (ctDNA-MRD) 指导II-III期胃癌 (GC) 患者辅助化疗的可行性:一项适应性试验 (MRD-GATE) [1]
图1. Abstract 4061
Feasibility of circulating tumor DNA-based minimal residual disease (ctDNA-MRD)-guided adjuvant chemotherapy in patients with stage II-III gastric cancer (GC): An adaptive trial (MRD-GATE)
研究背景
目前我国胃癌 (Gastric cancer, GC) 的早期诊断率仍较低,以进展期胃癌为主。针对局部进展期胃癌,D2根治术是主要的治疗手段,但手术后复发风险仍然较高,仅有50%的患者能够在首次手术时获得R0切除,且80%阴性切缘的患者仍会复发。为了改善胃癌患者的长期生存,术后辅助治疗的理念已经深入临床。对于可手术的GC患者,术后辅助化疗的规范化应用一直是临床实践中的难题。目前,对于可手术GC患者术后是否需要进行化疗,不同国家和地区存在差异,化疗适应症尚未统一。尤其对于II期GC患者,是否有必要接受术后化疗尚缺乏高级别证据支持。
研究设计与方法
本研究旨在探索术后ctDNA-MRD检测用于指导II-III期胃癌患者术后辅助治疗策略的可行性。采用高深度、定制化、tumor-informed策略的ctDNA检测方法来定量血液样本中的ctDNA。研究纳入接受R0切除和D2胃切除术的II-III期GC患者,在基线期 (术后28天) 及术后3、6、9、12、18、24、30和36个月进行ctDNA检测。根据MRD状态调整术后辅助化疗 (ACT) 方案 (如图2):
? 基线MRD阴性患者接受降级治疗 (II期观察,III期替吉奥单药治疗),若MRD转阳则转为联合ACT方案 (SOX:替吉奥+奥沙利铂;或XELOX:卡培他滨+奥沙利铂);
? 基线MRD阳性患者则直接接受联合ACT方案。
本研究的主要终点为3年无病生存 (DFS) 率,次要终点包括治疗降级率、基于MRD状态的DFS、累积复发风险 (CRR)、3 年总生存 (OS) 率和安全性。
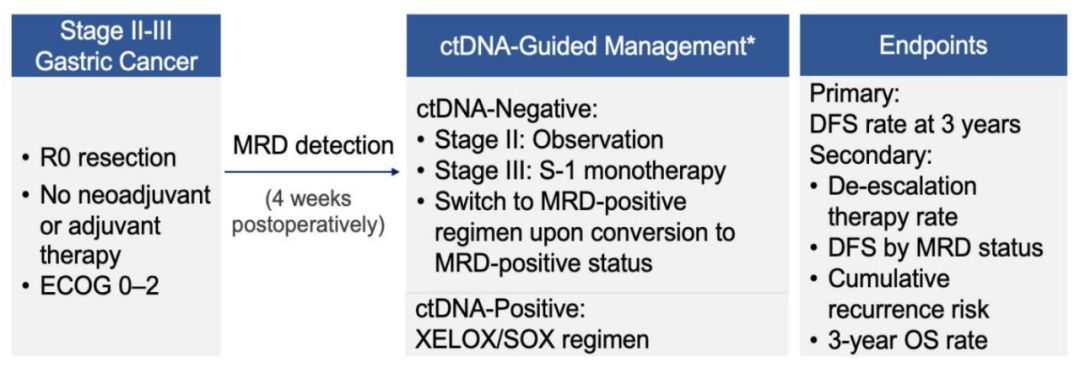
图2. 研究设计
亮点结果
01术后MRD阴性患者或可免于辅助化疗
至统计发布日止,研究共纳入65例GC患者 (31例为II期,34例为III期),中位随访时间13.3个月。
在意向治疗人群 (ITT, n=65) 中,14例 (21.5%) 患者为MRD基线阳性并接受联合ACT;51例 (78.5%) 患者为MRD基线阴性,其中6例阴性患者直接接受联合ACT,治疗降级率为69.2% (45/65),9例阴性患者在MRD转阳后接受联合ACT。整体1年DFS率为86.2%,1年OS率为96.9%,CRR为13.8%。24.6% (16/45) 接受降级治疗的患者发生3-4级不良事件。术后MRD阳性率低于30%,或提示多数患者有望豁免术后辅助化疗 (ACT),避免过度治疗伤害。
02术后MRD的状态与无疾病生存率显著相关
在意向治疗人群中,术后持续MRD阴性患者 (n=41) 的1年DFS率最高,达100%;而持续MRD阳性患者的1年DFS率最低,为0%,即全部患者在1年内发生疾病进展。术后发生MRD状态变化的患者 (阳转阴,阴转阳) 的1年DFS率约为70%。MRD检测可比影像学平均提早3.4个月发现患者复发/进展 (如图3)。
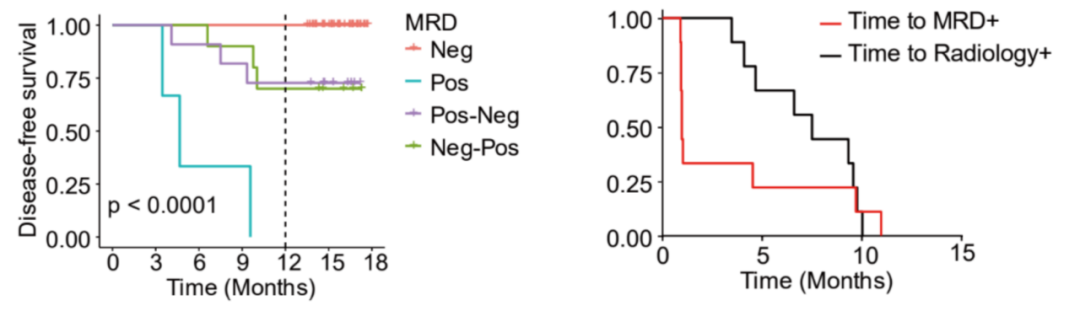
图3. DFS分析对比
ITT人群的1年期DFS分析 (左);MRD和影像学1年期DFS率对比(右)
总 结
高精度ctDNA-MRD检测或可帮助II-III期胃癌患者实现术后的降级治疗,在达到可接受的无疾病生存率的同时,可减少不良反应。
Signatera MRD是目前临床验证数据领先 (已发表临床研究100余篇),得到国外临床专家和监管部门认可 (NCCN结直肠癌指南引用,获得3项FDA突破性医疗器械认定、CE认证及7项美国Medicare政府医保覆盖) 的MRD检测技术。2019年,华大基因与美国著名的液体活检公司Natera签订了独家技术引进协议,成为中国唯一提供Signatera MRD检测的机构。借助华大国产测序平台MGISEQ2000,华见微®将可以惠及更多中国患者。











