近日,华大基因智惠医学研究院联合中国科学技术大学、河北医科大学等机构,在国际权威期刊Protein & Cell发表了关于阿尔茨海默病(AD)最新研究。
科学家们发现了反映疾病早期脑部异常的新型神经病变和生物标志物,为疾病早期诊断、干预和预防提供了新思路。
揭开早期“损伤”之谜
阿尔茨海默病是最常见的中枢神经系统退行性疾病,它以进行性认知功能障碍和行为损害为特征,病理上表现为β淀粉样蛋白斑块沉积、胶质细胞激活和突触缺失,最终导致记忆障碍和行为异常。
内嗅皮层-海马(Entorhinal cortex-hippocampal, EC-HPC)神经环路是大脑中参与学习、记忆和空间导航等认知功能的重要神经结构。
因其功能的特殊性和重要性,也成为AD病情发展中最易、最早受损和退化的脑区之一。EC-HPC回路特别容易受到AD病理影响,但其潜在的分子机制仍不清楚。

已有研究表明,EC-HPC神经环路的结构、功能和代谢异常在AD临床症状出现前就已发生。但不同神经元亚型在AD进展中的动态变化规律及其分子机制仍是未解之谜。
因此解析该环路响应AD病理的细胞分子动态变化,对深入理解疾病进展机制、发现潜在生物标志物和治疗靶点具有重要意义。
创新技术助力深化研究
研究团队通过高深度测序策略 Smart-seq2,跟踪了 AD 病理学不同阶段该回路内各种神经元类型的基因表达变化。希望通过整合多年龄段、多脑区、不同疾病阶段的动态变化深化对AD病理的认知,揭示疾病背后的细胞分子机制。
有别于现在实验多采用基于UMI的单细胞测序技术,该技术可为研究AD病理过程中脑细胞不同神经元的异质性提供高分辨率鉴定,从而达到动态观察神经元变化的结果。
研究团队通过Smart-seq2,对6/9/12月龄APP/PS1转基因小鼠和野生型小鼠的EC-HPC环路(包括内嗅皮层、海马CA1和CA3)区域神经元进行全转录组测序分析。
最终获得1,663个高质量神经元核数据。再通过细胞时序分析和加权基因共表达网络分析(WGCNA)进行神经元的病变追踪和分子机制解析。
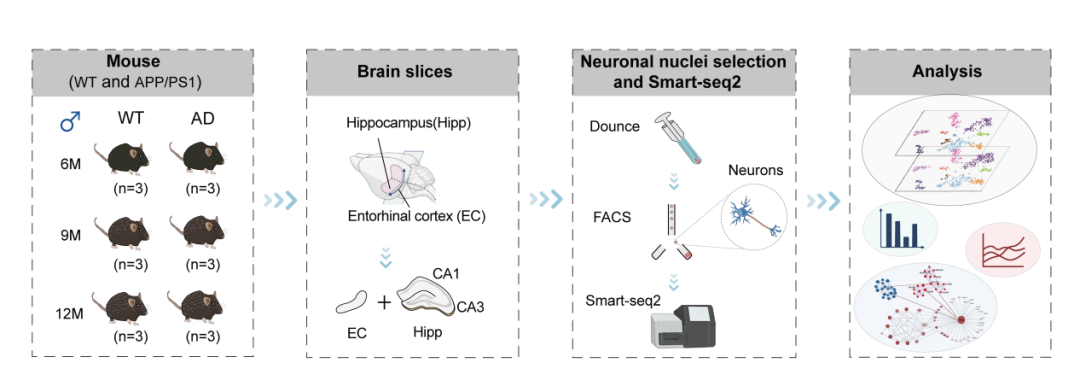
阿尔茨海默病理下内嗅-海马神经环路神经元全局分子探究
探究疾病进展新机制
研究团队共识别出9种不同神经元亚群,其中两类神经元被首次识别为疾病相关神经元,在AD的进展过程中表现出最为剧烈的变化,一类是星状神经元(EC-stellate)、另一类则是GFAP+神经元。
星状神经元是位于大脑内嗅皮层区的一类负责空间记忆功能的神经元细胞。在AD病理早期,星状神经元数目显著减少,表现出明显的线粒体功能和能量代谢障碍。

研究人员发现,引发这种变化的关键基因,是一个名叫 Meg3 的非编码RNA。它主要在星状神经元中异常激活,干扰线粒体与核糖体功能,导致细胞陷入能量代谢失衡,最终加速神经元死亡。
进一步研究发现,Meg3 的表达在AD早期快速升高,随后由于神经元的死亡而逐渐降低,像是一个“早期报警器”。Meg3的早期识别和干预可能是AD病理早期诊疗的新靶点。
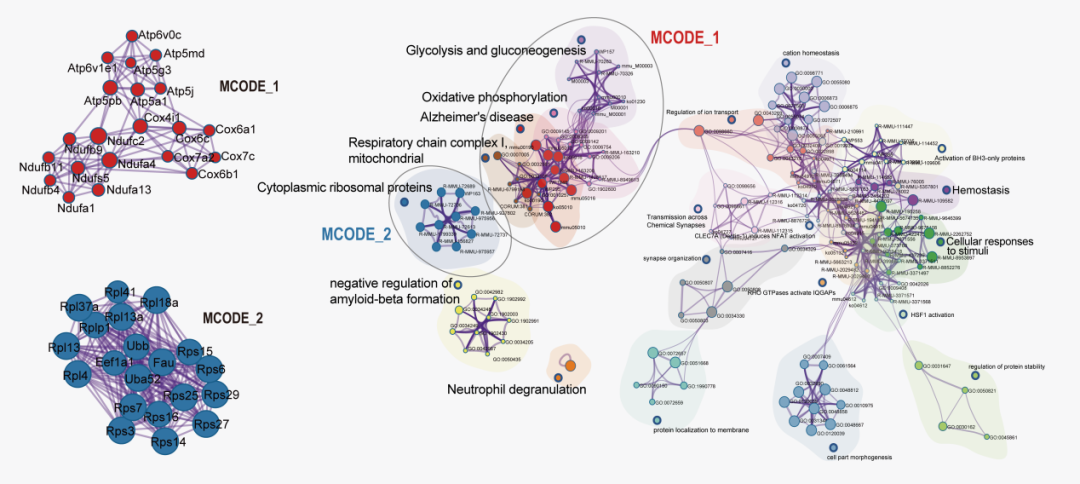
Meg3调控神经元能量代谢网络
胶质纤维酸性蛋白(GFAP)是一种主要存在于星形胶质细胞中的中间纤维蛋白,也是反应性星形胶质细胞的常用标志物。
近期,美国国立老化研究所与阿尔茨海默病协会(NIA-AA)也已将GFAP推荐为AD的临床生物标志物。GFAP的高表达通常被视为星形胶质细胞激活的特异性标志物。

然而,研究团队发现在AD大脑的EC-HPC环路中存在一群独特的GFAP+神经元,其GFAP表达显著上升,并且GFAP+神经元数量会随病情的发展显著增加。通过AD患者及多种AD小鼠模型的数据,研究团队对该发现进行了严格验证。
GFAP+神经元最初出现在AD脑内的海马CA3区,随后扩散至CA1区及内嗅皮层区域。最终,在AD患者去世后的内嗅皮层中,病理性GFAP+神经元占神经元总数的38%,而年龄匹配的对照组中该比例仅为2%。
从分子层面来看,随着AD病理的进展,GFAP+神经元表现出非常明显的神经元特征退化及胶质特征增强的特点,同时会激活干性标志物。
此外,GFAP+神经元中PIG(plaque-induced genes)基因的显著激活,以及研究人员在带有偶发弥漫样斑块的对照样本中也检测到了GFAP+细胞,同样表明了GFAP+神经元与AD病理密切相关。
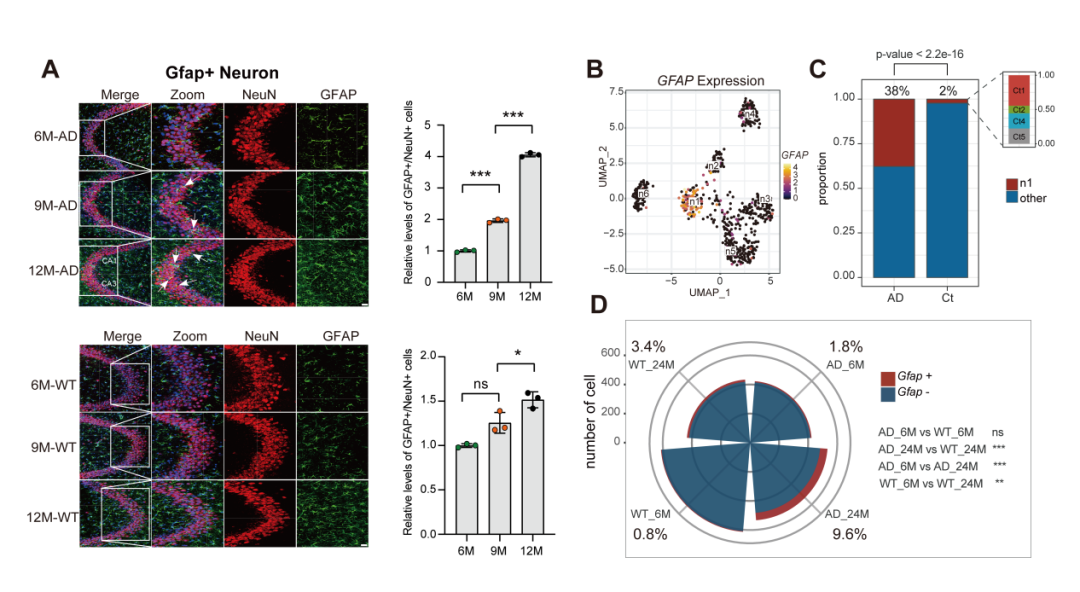
GFAP+神经元是AD患者、APP/PS1及APP23小鼠大脑中共有的疾病神经元
研究人员表示,这种广泛影响EC-HPC环路神经元的胶质化病变,可能是导致AD患者记忆环路神经元功能退化和认知障碍的关键。恢复GFAP+神经元的神经元特征与功能,可能成为逆转AD神经退行性表型及恢复认知功能的潜在治疗靶点。
此外,此次研究也为AD的演变描绘了更清晰的路径:从早期的能量代谢紊乱,到中期的神经元丢失和病变,再到晚期神经元功能退化与记忆丧失。科学家提供了AD病理下EC-HPC环路神经元的全周期动态细胞变化和分子机制。为追踪疾病提供了参考,也为AD干预的提供了新方向。
阿尔茨海默病可能在更早阶段就已悄然启动。识别这些微妙却关键的脑部信号,或许能帮助我们在记忆被夺走前,找到阻断疾病进程的机会。











